

Entre cristal et liquide
Cristaux liquides et Cristaux plastiques
Alain Boudet
Dr en Sciences Physiques
Résumé: Les cristaux liquides sont des substances qui lorsqu'on les chauffe, passent par des structures intermédiaires entre le cristal à réseau périodique bien ordonné dans trois directions et le liquide complètement désordonné. Dans ces états, ils tiennent à la fois du liquide et du cristal. Ces structures résultent de la forme non-sphérique de leurs molécules qui s'empilent comme des allumettes, des assiettes, les cartes d'un jeu de cartes ou encore des hélices. Ce sont ces mêmes cristaux liquides qui se cachent dans les écrans numériques sous le sigle LCD. Les cristaux plastiques ont par contre des molécules quasi-sphériques et ils représentent une autre façon d'inventer un ordre intermédiaire, dû à la mobilité rotationnelle de leurs molécules.
Cristal... liquide... Deux mots qu'il semble étrange d'associer. Comme leur nom l'indique, les cristaux liquides tiennent à la fois du cristal et du liquide. Mais comment peuvent-ils être l'un et l'autre, sans être ni l'un ni l'autre? Quelles images ou pensées ces mots évoquent-ils pour vous?
Peut-être imaginez-vous une substance qui présente la transparence cristalline, et qui est également dotée de la faculté de se mouvoir comme un liquide. Un cristal fluide.
À moins que, familier de la technologie, vous ne pensiez aux écrans à cristaux liquides, connus, au moins de nom, par un public intéressé par les procédés en matière d'affichages lumineux. Les cristaux liquides sont abondamment utilisés dans la fabrication des cadrans de montres, écrans d'ordinateurs portables, téléphones portables, télévision et jeux électroniques.
Pour comprendre les cristaux liquides, nous devons d'abord savoir ce que signifient les notions de cristal et de liquide.
On les définit par la façon dont sont arrangés leurs atomes ou molécules. La structure cristalline se caractérise par un empilement géométrique régulier et répétitif d'un petit motif de quelques atomes. Le quartz et le diamant sont des cristaux typiques.
Un cristal bien dur peut devenir liquide quand on le chauffe à une température suffisante. Par exemple, un métal est une substance cristallisée qui devient liquide et apte à être coulée et moulée dans un récipient. Inversement, en refroidissant un liquide, il peut cristalliser comme le fait l'eau. Des petits cristaux naissent dans le liquide et se mettent à grossir.
Les notions de cristal et de liquide sont examinées de façon approfondie dans l'article Géométrie cristalline.
Le passage de l'état de liquide à celui de cristal est un changement physique brusque. Le liquide est fluide. Il n'a pas de forme en lui-même, il adopte celle du récipient dans lequel on le verse. Le cristal est compact et dur et conserve la forme dans laquelle il a été façonné.
Cette transformation observable à l'œil nu ou au microscope est la manifestation visible d'un processus atomique. Le plus spectaculaire est la modification de l'ordre atomique et moléculaire. Dans le liquide, les atomes se meuvent librement dans tous les sens et sont distribués un peu partout en désordre. Au moment de la cristallisation, ils viennent se ranger en ordre compact. C'est cet ordre serré et ordonné qui caractérise un cristal.
Remarquons qu'il existe des matières solides qui présentent aussi le désordre moléculaire du liquide. Ce sont les verres ou matière vitreuse. Le verre est un liquide figé, un "arrêt sur image" du liquide. Ses atomes restent en désordre, même s'ils se sont immobilisés. De ce point de vue, le changement entre un liquide et un verre est minime. Verre et liquide sont tous les deux dans l'état qualifié d'amorphe, qui indique l'état de désordre, ou de distribution aléatoire de la position des atomes. Il arrive que des verres cristallisent quand on abaisse la température ou dans d'autres circonstances favorisantes. La transformation entre le désordre moléculaire amorphe et l'ordre cristallin est radicale.
Et les cristaux liquides? C'est dans le passage subtil entre liquide et cristal lors du refroidissement qu'ils vont se révéler. En effet, dans cette métamorphose, certaines substances particulières ne passent pas directement de l'état liquide à l'état cristallin. Pendant le refroidissement, elles passent par des états intermédiaires. Elles sont encore liquides, mais ont perdu de la fluidité et ont une apparence trouble. Au niveau moléculaire, on détecte un ordre partiel, de telle sorte qu'elles sont liquides par certains aspects, mais ordonnées comme un cristal selon d'autres. Ce sont ces substances qui sont nommées cristaux liquides.
Le premier à mentionner l'existence de telles substances dans le monde scientifique a été le botaniste autrichien Friedrich Reinitzer en 1888. C'est donc relativement récent. Il est probable que d'autres avant lui avaient vu de telles substances, sans en comprendre la singularité. En effet, il ne suffit pas d'être en face d'un phénomène pour le comprendre, il faut que l'attention soit captée et amenée à l'interpréter d'une façon nouvelle. Ainsi, l'observation d'un liquide trouble ne fait pas immédiatement penser à une nouvelle structure. Ou même, on n'y prête aucune attention car cela ne fait pas partie des références connues.
C'est à ces doutes qu'a été confronté Reinitzer. Il étudiait des cristaux de benzoate de cholestérol et leur transformation sous l'effet de la chaleur. La température de fusion d'une substance dépend de sa pureté. Or, une substance n'est jamais pure à 100%. Elle contient toujours une petite quantité de molécules ou atomes étrangers qui proviennent de la matière dont elle est extraite à l'origine ou des produits de réaction ou de synthèse. Selon le procédé de purification, on a des puretés de 1%, ou de 0,1%, ou encore une part pour mille ou un million pour les plus élaborés.
En chauffant le benzoate, Reinitzer a constaté qu'il fondait à 145,5 °C et devenait un liquide visqueux et laiteux. Éclairé en lumière blanche, ce liquide renvoie des reflets colorés qui indiquent qu'il est structuré à la manière d'un cristal. Puis ce liquide subit une seconde transformation en un liquide clair à 178,5°C.
À cette époque, l'existence de deux températures de fusion était difficilement concevable. Les scientifiques avaient identifié 3 états possibles de la matière, solide, liquide et gaz. On détectait un point de transition entre le solide et liquide, la fusion, et un autre entre liquide et gaz, l'ébullition. Ainsi l'eau fond à 0°C à la pression atmosphérique normale et bout à 100°C. Alors comment expliquer l'existence de 2 points de fusion?
Tout d'abord, Reinitzer pense que c'est l'indication de la présence d'impuretés, mais une purification poussée aboutit au même résultat. Avec le recul et les applications techniques actuelles, l'existence des cristaux liquides est devenue une évidence. Pourtant au moment de leur découverte, ils ont fait débat. L'équipe de recherche a été soupçonnée de ne pas avoir pris toutes les précautions de propreté dans ses expériences. Un exemple parmi bien d'autres qui montre que la communauté scientifique est généralement peu encline à accepter des trouvailles qui sortent du cadre établi (voir Controverses dans l'article Matière et rayonnements)
| Les pères des cristaux liquides | ||
 |  |  |
| Friedrich Reinitzer (1857 - 1927) | Otto Lehmann (1855 - 1922) | Georges Friedel (1865 - 1933) |
Pour l'aider à comprendre l'origine de cette transition intermédiaire, Reinitzer sollicite un spécialiste de l'optique cristalline, le physicien allemand Otto Lehmann. Celui-ci établit que le liquide visqueux, comme le cristal, présente des particularités optiques qui dépendent de l'orientation dans laquelle on le regarde ou l'analyse. En 1905, il démontre que le liquide laiteux est un état de la matière à part entière qui n'a ni la symétrie du cristal, ni celle du liquide.
Il s'agit d'une structure ordonnée particulière intermédiaire entre le cristal solide et le liquide clair, que Lehmann nomme cristal liquide. Ce nom s'est imposé dans la pratique, même si par la suite, on s'est aperçu que les cristaux liquides n'étaient ni cristallins, ni vraiment liquides. Pour cette raison, on les nomme aussi états mésomorphes (meso en grec = intermédiaire).
Vers 1920, le français Georges Friedel s'attaque à la détermination des symétries des arrangements moléculaires. Diplômé de l'École Polytechnique et de l'École des Mines, il a la charge de nombreuses activités liées à ses compétences, et il est passionné par la minéralogie et la cristallographie. Il décrit les structures atomiques des cristaux liquides dans leurs différents états (on dit aussi leurs phases) intermédiaires et il établit une classification. Il insiste sur le caractère discontinu des transformations: une substance passe d'une structure moléculaire à une autre sans transition.
Qu'est-ce qui est nouveau dans la nature des cristaux liquides, qui est absent dans les autres types de matière, et qui entraine leurs caractéristiques particulières? La réponse tient dans la forme particulière de leurs molécules.
Les cristaux minéraux habituels sont faits d'atomes qu'on considère comme sphériques, et qui s'empilent selon des schémas simples, tels que des carrés, des losanges ou des hexagones (article Géométrie cristalline). Les cristaux liquides sont des empilements de molécules, non d'atomes. Certes, les molécules sont elles-mêmes des assemblages d'atomes, mais ces atomes sont fortement reliés entre eux, de telle sorte qu'on peut considérer les molécules comme des objets solides en soi. Or ces objets n'ont pas forcément des formes sphériques.
Certaines molécules peuvent s'empiler en cristaux moléculaires. Si elles sont à peu près sphériques, elles s'arrangent en structures semblables à celles des cristaux atomiques, en plus dilaté (voir plus bas, Cristaux plastiques).
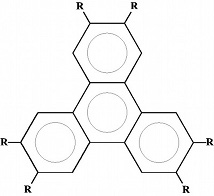
Si les molécules ont des formes allongées ou boursoufflées, cela va entrainer d'autres types d'empilement. C'est le cas des cristaux liquides, dont les molécules peuvent avoir des formes variées: bâtonnets, disques, étoiles, pyramides, virgules, etc.
Prenons à titre d'exemple une forme que l'on rencontre abondamment dans les cristaux liquides: la forme allongée en bâtonnet ou en aiguille. Vous ne pouvez pas assembler des bâtons d'allumettes comme vous assemblez des balles. Vous n'arrangez pas des bananes dans un panier comme des oranges. Lorsqu'on empile des bâtonnets, une tendance naturelle est de les positionner dans la même orientation, comme dans une boite d'allumettes. On obtient quelque chose qui n'existe pas dans un empilement de sphères, c'est un ordre d'orientation.
Une autre caractéristique importante est la mobilité qui reste entre les molécules. Oui, les molécules en bâtonnets ont une tendance à s'aligner et se rapprocher, mais leurs attirances réciproques sont faibles. De même que des allumettes peuvent bouger dans leur boite si vous secouez un peu, de même les molécules peuvent facilement glisser les unes par rapport aux autres. C'est cette mobilité qui les apparente aux liquides. Les cristaux liquides dans leur phase intermédiaire sont généralement visqueux ou pâteux, sans atteindre la fluidité d'un liquide.
Lorsqu'on chauffe, l'espace entre bâtonnets augmente jusqu'à ce qu'ils puissent tourner dans tous les sens. L'ordre d'orientation se perd, la mobilité augmente. On est dans la phase liquide.
Examinons en détail les structures produites par ces bâtonnets, dont les deux plus connues et les plus étudiées sont l'ordre nématique et l'ordre smectique.
Observons une de ces substances au microscope. Nous en déposons une goutte sur une lame de verre que nous plaçons sur la platine chauffante et refroidissante du microscope à lumière. Nous réglons la température pour être dans cette phase intermédiaire, le liquide trouble et visqueux.
Nous voyons des plages homogènes séparées par des lignes noires courbes très flexibles qui rappellent des fils. Ce sont ces figures qui leur ont valu leur nom de nématique (grec ancien nematos = fil).
 |  |
| Texture de fils dans un nématique In memoriam, je remercie vivement le professeur Yves Bouligand (EPHE, Paris, France) pour le don de cette photo et pour les discussions simples et chaleureuses que nous avons partagées il y a quelques années | Microscope dit "à lumière" ou "photonique", pour le distinguer des microscopes électroniques |
Si nous concentrons notre regard sur un endroit, par exemple le centre de l'une des plages uniformément claires, et que nous faisons tourner la lame pour modifier l'angle d'observation, nous voyons les fils se déplacer, l'aspect global restant le même. Des expériences de cette sorte, ainsi que les diffractions des rayons X ont conduit aux résultats suivants.
Dans l'état nématique, les molécules sont approximativement orientées dans le même sens et assemblées comme nos allumettes évoquées plus haut. Elles ont la possibilité de glisser les unes sur les autres comme des troncs de bois flottant sur une rivière. Aussi, les centres des molécules sont placés de façon aléatoire, en désordre. Il n'apparait donc aucun ordre de position, tout comme dans un amorphe. L'ordre de leur assemblage est un ordre d'orientation et uniquement cela.
En réalité, les molécules en bâtonnet n'obéissent pas de façon stricte à cet ordre. Leur parallélisme est approximatif. Leurs orientations se dispersent légèrement les unes par rapport aux autres autour d'une direction moyenne. De même que les allumettes ont du jeu dans leur boite, de même l'orientation des molécules du cristal liquide est moyenne. Les écarts sont plus ou moins importants et peuvent varier en fonction des conditions.
 | 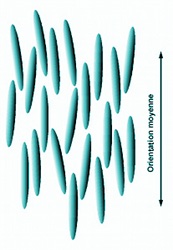 |  |  |
| Structure d'un nématique | Nématique avec une plus grande liberté d'orientation | Flottage du bois sur l'Amazone, | Schéma de disposition des bâtonnets avec plusieurs domaines d'orientation |
Comment cette structure schématique de molécules parallèles s'accorde-t-elle avec notre observation des textures de fils? Nous devons pour cela élargir notre vision. La structure décrite est vraie localement, comme si nous regardions uniquement quelques troncs proches qui flottent. Si nous prenons du recul, nous voyons des groupes de troncs dans des orientations différentes. De même pour les molécules, on constate que différents domaines avec des orientations différentes sont juxtaposés. L'image des troncs a ses limites, car en ce qui concerne les molécules, on peut passer d'un domaine à l'autre par un changement d'orientation progressif, quoique avec une forte courbure. Les fils sont les traces de ces courbures.
Si nous refroidissons le nématique, il est fréquent qu'il passe par une ou plusieurs autres phases intermédiaires avant de prendre la structure cristalline. Ce sont des phases smectiques.
Au microscope, en refroidissant, la goutte de nématique se réorganise. Les textures de fils s'évanouissent pour laisser place à une autre texture, typique des smectiques. On y découvre des formes en éventails plus ou moins orientées et imbriquées. Elles donnent une impression de formes plus géométriques, rectilignes, anguleuses, plus rigides ou cristallisées. Tout en restant relativement mobile en tant que cristal liquide, le smectique a moins de flexibilité que le nématique.
L'analyse aux rayons X montre que les molécules sont disposées en couches superposées. Dans ces couches, elles restent parallèles à une même direction, comme un nématique réduit à deux dimensions. La structure smectique a donc en commun avec les nématiques l'ordre d'orientation des molécules. Ce qui est nouveau, c'est la répétition en couches les unes au-dessus des autres.
Il apparait une longueur caractéristique dans les smectiques, c'est l'épaisseur de la couche. C'est donc la distance de répétition dans la direction perpendiculaire aux couches. Elle est liée à la longueur des molécules, environ 3 nanomètres, donc bien au-delà de la capacité de voir les couches au microscope.
 |  |  |
| Structure en couche d'un smectique A | Texture en éventails d'un smectique | Structure en double-couche d'un savon |
De la même façon que dans les nématiques, l'orientation des molécules est une orientation moyenne, autour de laquelle leurs axes se dispersent plus ou moins. Comme pour les nématiques, des domaines d'orientations différentes sont juxtaposés. À l'intérieur de domaines étendus, les couches se courbent et se disloquent, ce qui crée les textures en éventails.
C'est Georges Friedel, lors de ses classifications structurales, qui a donné leur nom aux smectiques. Smectique vient du nom grec ancien smectos qui signifie savon. Pourquoi savon, puisque nous n'avons pas affaire à des savons? Parce qu'avec son microscope, Friedel n'avait pas des données aussi précises que celles que nous fournissent les rayons X, et qu'il existe des analogies structurales fortes entre les smectiques et les savons. Comme les smectiques, les savons ont une structure en couches qui contiennent des molécules parallèles.
Toutefois, la structure des savons diffère de celle des smectiques. Elle se caractérise par un élément supplémentaire essentiel, qui n'est pas retenu dans la définition de la structure smectique: Les molécules des savons sont polarisées, autrement dit leurs deux extrémités sont très différentes.
Dans les nématiques et dans les smectiques, nous avons été en présence de molécules qui ont des extrémités équivalentes, quoique différentes. On peut dire qu'elles ont deux queues, et les molécules peuvent être orientées indifféremment vers le "haut" ou vers le "bas". Elles se mélangent allègrement dans les deux sens.
Dans le cas des savons, les molécules ont deux extrémités bien différenciées. On peut dire qu'elles ont une tête et une queue et on peut repérer leur sens. La tête supporte difficilement la présence de la queue d'une autre molécule. Les têtes s'arrangent pour se trouver toutes du même côté, côte à côte. À cause de sa structure chimique, donc électrique (voir sur ce sujet l'ADN électrique), la tête a une affinité pour l'eau (elle est hydrophile). La queue a horreur de l'eau (elle est hydrophobe). À cause de cal, les couches sont doubles, les queues d'une couche se protègent en se rassemblant avec les queues de la suivante. Ainsi, les deux couches sont en miroir, les molécules de l'une pointent vers le haut, celles de l'autre vers le bas.
Les têtes de deux couches adjacentes se font également face. Lorsqu'on met le savon dans l'eau, les queues refusent l'eau et restent accrochées. Par contre, les têtes accueillent cette eau qui se glisse entre elles et les désolidarise de la double couche suivante. Les doubles couches deviennent mobiles, autrement dit solubles dans l'eau.
Le passage du liquide au nématique, puis du nématique au smectique s'effectue avec un changement structural brusque et une augmentation de la densité. Chaque phase a ses propres caractéristiques physiques. On les nomme phases mésomorphes. Le passage d'une phase à une autre a lieu à une température de transition caractéristique de la substance.
Prenons un cristal liquide en bâtonnets et chauffons-le jusqu'à l'état liquide. Dans la phase liquide, les bâtonnets sont en mouvement perpétuel, tournent dans tous les sens et se déplacent. Si on repère leur position par un point au centre de la molécule, leur centre de gravité par exemple, les centres sont distribués de façon désordonnée. Si on fige la situation dans le temps, on a la structure amorphe: aucun élément d'ordre.
Lorsqu'on refroidit ce cristal liquide, les molécules se resserrent. C'est une condensation. On passe de la phase liquide à la phase nématique. Là, apparait un nouvel ordre: l'orientation des molécules. Alors qu'elles étaient dans tous les sens, elles se rapprochent, et choisissent une direction commune localement. Les molécules perdent en liberté individuelle et l'ensemble gagne un élément d'ordre.
Alors que toutes les orientations étaient équivalentes, voilà qu'une direction est privilégiée. Il y a un changement de symétrie. Les scientifiques disent une rupture ou brisure de symétrie. Car comment les molécules choisissent-elles leur orientation parmi toutes les directions possibles? Il faut s'engager dans une seule voie.
En continuant à refroidir, la substance passe à la phase smectique. Les centres des molécules sont maintenant alignées en couches. Ces couches sont disposées selon une périodicité le long d'une dimension. La substance y gagne un élément d'ordre de position.
On peut aussi décrire cette structure smectique à partir d'un réseau cristallin tridimensionnel en introduisant un élément de désordre. Alors que dans les cristaux, tout est en place de façon fixe, dans les smectiques, les couches peuvent glisser les unes par rapport aux autres et tourner, tout en restant en contact, comme les cartes d'un jeu de cartes. Cela entraine par exemple que l'orientation des molécules dans une couche est indifférente à celle de la couche adjacente.
Si nous refroidissons encore plus, nous n'obtenons généralement pas immédiatement le cristal. Entre le smectique que nous avons décrit et le cristal, il existe d'autres phases intermédiaires dans lesquelles les couches acquièrent plus d'ordre et moins de symétrie. Comme ces phases restent en couches, on les nomme également des phases smectiques et on précise son type par une lettre.

Structure d'un smectique C
©A. Boudet, CNRS éditions
Le smectique que nous avons étudié plus haut est le smectique A. Ses molécules s'orientent en moyenne perpendiculairement aux couches. Lorsque la température est abaissée, un smectique A peut passer à une structure dont les molécules sont inclinées (smectique C).
Même si les bâtonnets sont contraints d'être parallèles et de s'organiser en couches, il leur reste une grande liberté de compactages possibles à l'intérieur des couches. Les couches des smectiques A et C ne présentent aucun ordre de position, comme dans les nématiques. C'est une sorte de nématique à deux dimensions.
Si la température diminue, l'ordre se fait plus pressant. Dans la couche, les bâtonnets se resserrent et s'ordonnent en arrangements réguliers plus ou moins étendus, selon un réseau périodique souvent rectangulaire ou hexagonal. Une couche est devenue une sorte de cristal à deux dimensions. Le cristal liquide est un empilement de ces cristaux à deux dimensions. Mais alors, en quoi diffère-t-il d'un vrai cristal? Par l'absence de corrélation d'une couche à l'autre.
Enfin, tout en bas de l'échelle de température, on arrive à la phase cristalline. Les couches se sont calées les unes par rapport aux autres.
Au final, les cristaux liquides peuvent compter 1, 2 et jusqu'à 5 phases mésomorphes entre le solide et le liquide.
Arrêtons-nous un peu plus sur l'emploi du mot bâtonnet quand cela concerne une molécule. Est-il possible de définir la forme d'une molécule?
Une molécule est un assemblage d'atomes qui sont reliés entre eux par des liens solides, mais généralement souples. Ces liens sont souvent articulés. Des groupements d'atomes peuvent tourner les uns par rapport aux autres comme les segments articulés d'un squelette.
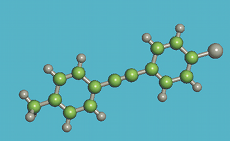
L'atome de carbone est un composant majoritaire des molécules de cristaux liquides. Les atomes de carbone peuvent s'assembler en chaines articulées souples. Toutefois, leur rotation peut être bloquée à certains endroits. Ils ont aussi la possibilité de s'assembler en un cercle rigide de 6 atomes. Cette configuration est l'élément de base du benzène et pour cette raison, on la nomme noyau benzénique. Selon la flexibilité et l'amplitude des articulations du carbone, la molécule est souple et déformable, ou elle a une forme définie rigide. Elle peut aussi avoir des parties souples et d'autres rigides. Ce sont les parties rigides qui lui confèrent sa forme.
  |   |  |
| Molécule en forme de bâtonnets | Molécule en forme de disque | Assemblage de colonnes de disques |
| ©A. Boudet, CNRS éditions | ||
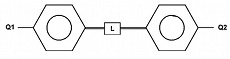
Les bâtonnets sont constitués d'un assemblage de noyaux benzéniques reliés par des liens rigides. L'ensemble constitue la partie rigide de la molécule. Cette partie est prolongée aux deux extrémités par des queues flexibles et mobiles (Q1 et Q2). La taille des molécules est microscopique, quelques nanomètres de longueur et quelques dixièmes de nanomètre de section. Les différents cristaux liquides diffèrent par la composition et l'emplacement de la partie rigide et des queues.
Des molécules ayant d'autres formes s'empilent en d'autres types de structures mésomorphes. En inventant de nouvelles molécules, on peut créer des structures étranges et exotiques. Les chimistes savent parfaitement construire des molécules avec des formes déterminées, comme un jeu de construction: par exemple rubans ou disques. Ils greffent des queues flexibles à des noyaux rigides. Si on prolonge un noyau dans plusieurs directions coplanaires, on a des molécules plates.
Des molécules en forme de disques s'empilent comme des piles d'assiettes. Elles forment des colonnes qui se disposent côte à côte selon un ordre périodique. Cette structure est appelée discotique.
Enfin d'autres molécules sont torsadées. Leurs empilements reflètent alors ce caractère de torsion, ce sont les cholestériques.
Imaginez que vous disposez des bananes dans un cageot. Si elles sont à peu près identiques, vous pouvez les arranger en rangées. Quand le fond est rempli, vous faites une deuxième couche. La première banane de la deuxième couche a tendance à se caler dans le trou entre deux bananes de la couche inférieure. Il y a donc un décalage de position entre les deux couches, mais elles sont orientées de la même façon.
Imaginez maintenant que les bananes sont d'une espèce spéciale: elles rebiquent à une extrémité. Au lieu d'être posées bien à plat au fond du cageot, il y a un bout qui se dresse, mais pas vraiment verticalement, plutôt en oblique. L'empilement de la deuxième couche ne se fera pas aussi simplement. Les bananes du dessus devront être légèrement tournées par rapport à celles du dessous. La troisième couche sera également tournée par rapport à la deuxième. La forme avec un bout relevé imprime une torsion à l'empilement.

Texture cholestérique en empreintes digitales,
observées au microscope à lumière
Merci à Ingo Dierking, Chalmers University

Schéma de la structure cholestérique
©Dessin A. Boudet, CNRS éditions
C'est ce qui se passe pour les cholestériques. La première substance étudiée par Reinitzer était un dérivé du cholestérol, et c'est ce qui a donné son nom à cette classe de cristaux liquides.
Au microscope, on découvre des lignes courbes équidistantes et parallèles qui dessinent des figures caractéristiques en empreintes digitales. La distance entre deux lignes voisines est de l'ordre du micromètre, donc suffisamment grande pour être bien visible au microscope. Cette distance entre deux lignes voisines est unique et répétitive. C'est une signature caractéristique du cholestérique observé.
Cette périodicité est la conséquence directe de l'assemblage torsadé. Dans les cholestériques, il n'y a pas vraiment de couches comme je l'ai décrit avec les bananes, ce qui est seulement une image approximative. Ce sont plutôt des plans qui se chevauchent. Si nous conservons l'image d'un empilement du fond vers le haut, l'orientation des molécules se modifie de façon continue du fond jusque sur le dessus. Arrivés à une certaine épaisseur, on retrouve l'orientation initiale, on a tourné de 360°. C'est cette épaisseur qui est la distance entre deux lignes, la périodicité.
Dans un cholestérique, les molécules sont parallèles entre elles dans un plan - celui qui correspond au fond du cageot par exemple (voir la figure ci-contre). Dans ce plan, comme dans les nématiques, elles n'ont pas de position déterminée. Seule leur orientation est imposée, avec quelques écarts possibles. Dans un tel plan, le cholestérique est identique à un nématique. On passe progressivement aux autres plans parallèles et d'un plan à l'autre, l'orientation commune subit une rotation progressive.
Cette disposition est par définition une disposition en hélice. L'orientation d'un élément tel qu'une molécule tourne régulièrement au fur et à mesure qu'on avance le long d'une direction. C'est le principe d'un boulon et du filet qui est gravé dessus. Lorsqu'on tourne le boulon, il avance dans l'écrou. Chaque fois qu'on fait un tour complet, il avance d'une distance qui est la longueur entre les deux filets, c'est le pas de l'hélice. Il y a des boulons avec des pas fins, qui avancent doucement, et des boulons avec des pas larges, qui avancent très vite. La direction de progression, c'est l'axe de l'hélice (voir article Spirales et Hélices).
Comme on le voit sur les figures, les lignes périodiques ne restent pas droites sur toute l'étendue de la goutte de cholestérique. Elles s'incurvent, quelquefois brusquement, et donnent naissance aux figures en empreintes digitales. Ailleurs, elle forment de belles spirales.
 |  | |
| Figures en empreintes digitales dans un cholestérique, observées en microscopie électronique en transmission. © Cliché A. Boudet, CNRS éditions | Détails © Cliché A. Boudet, CNRS éditions | Spirales dans un cholestérique. Microscopie électronique en transmission. © Cliché A. Boudet, CNRS éditions |
L'hélicité de la structure cholestérique est induite par la forme particulière asymétrique des molécules. Le mot symétrie peut rester imprécis, aussi je donne quelques explications. Il existe de nombreux types de symétries et lorsqu'on parle d'un objet qui est symétrique, il est nécessaire de préciser selon quel mode. Le corps humain est à peu près symétrique selon un plan qui le traverse en séparant sa moitié gauche et sa moitié droite, un plan vertical avant-arrière (plan médian ou sagittal). Cela signifie qu'une moitié (on ignore ici les détails) est identique au reflet de l'autre dans un miroir. Une forme est dite symétrique par rapport à un plan si on peut trouver un tel plan de référence. Un point sur une moitié a sa correspondance dans son symétrique de l'autre moitié. On peut aussi décrire des symétries par rapport à une ligne ou un point.
Les cylindres comme nos bâtonnets ont un axe de symétrie, et même plusieurs. De même les disques. Ils peuvent tourner autour de l'axe sans que leur apparence en soit changée.


©Cliché A. Boudet
Considérons maintenant nos mains. Une main seule ne présente pas d'élément de symétrie. Si on la partage en deux, on aura le pouce d'un côté, mais pas de l'autre. La main, comme les molécules cholestériques, est asymétrique. Mais, si l'on considère nos deux mains, elles sont symétriques l'une de l'autre. Il y a une main gauche qui est le reflet en miroir de la main droite. On peut définir un sens à la main: gauche ou droite, car elles ne sont pas identiques. Ce n'est pas le cas d'un objet symétrique comme un bâton. Lorsqu'on peut définir un sens à un objet, il a sa correspondance dans l'objet de sens opposé, identique à son reflet dans un miroir. C'est une symétrie chirale (prononcez kiral, c'est le ? grec!). Le mot chiralité est forgé d'après un mot grec ancien qui signifie justement la main (il a donné aussi chiromancie, chiropractor).
Autre exemple d'objet chiral: une petite cuillère normale est symétrique puisque sa moitié gauche est identique à sa moitié droite en reflet. Si on tord et vrille la cuillère sur un côté, on lui donne un sens droit ou gauche. Dans le monde des cuillères, il existe des cuillères tordues à gauche et d'autres à droite. Dans le monde des molécules, il existe des molécules de gauche et des molécules de droite.
Chaque fois qu'apparait une spirale ou une hélice, on a un objet chiral. Les hélices et les spirales sont de deux types, celles qui s'enroulent dans un sens et celles qui s'enroulent dans l'autre. Les tire-bouchons en sont un exemple familier. Ils sont ordinairement à droite, ce qui nous oblige à tourner à droite pour qu'ils s'enfoncent dans le bouchon. Mais dans les magasins de farces et attrapes, on trouve des tire-bouchons gauches qui s'enfoncent en tournant à gauche.
Le caractère chiral apparait de façon fréquente dans la nature, aussi bien dans les formes spiralées des coquillages et des végétaux qu'au niveau des galaxies (voir Spirales et hélices), et dans les molécules torsadées de l'ADN (voir ADN et code génétique). La chiralité, c'est donner un sens de rotation.
Les cholestériques sont des nématiques auxquels la chiralité des molécules a donné un caractère hélicoïdal. Notons qu'il existe également des smectiques chiraux. Ils possèdent à la fois la structure en couches des smectiques et l'arrangement hélicoïdal des molécules chirales.
Les cristaux liquides ne sont pas les seules substances à présenter une phase mésomorphe. La nature a inventé d'autres façons d'introduire un ordre partiel entre liquide et cristal. C'est le cas des cristaux plastiques.
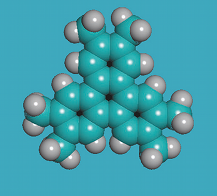
On s'est aperçu de l'existence des cristaux plastiques en constatant leur comportement lorsqu'on les chauffe à partir de l'état cristallin. C'est J. Timmermans qui les a découverts en 1938. Il cherchait à comprendre comment la chaleur nécessaire pour faire fondre des composés organiques (des molécules à base d'atomes de carbone) dépendait de leur constitution chimique. Il s'aperçut que certains composés organiques de structure relativement simple présentaient une température de fusion anormalement élevée. Les molécules de tous ces composés étaient à peu près sphériques.
Un cristal plastique présente une phase intermédiaire entre le solide et le liquide. En le chauffant à partir l'état cristallin, on observe une transition vers une phase plus plastique, déformable, d'où leur nom. Elle a un aspect doux et cireux. Elle se maintient jusqu'à une autre transition vers la phase liquide. Par exemple, l'adamantane présente une transition à -64 °C et devient liquide à 269 °C.
Les cristaux plastiques sont des cristaux moléculaires, donc constitués d'un empilement de molécules. Les molécules sont plus grosses que des atomes puisque faites d'un groupement d'atomes liés. Les réseaux moléculaires sont semblables à ceux des cristaux atomiques ordinaires, cubiques, tétragonaux ou hexagonaux, mais en plus dilaté. Au moment du changement d'état à la phase plastique, les centres de gravité des molécules conservent ou non la position qu'ils occupaient à l'état solide. Ainsi, le réseau de l'adamantane est tétragonal dans sa phase cristalline au-dessous de -64 °C et devient cubique à faces centrées dans sa phase plastique.
Ce n'est pas dans ce changement de symétrie du réseau - qui n'a pas forcément lieu - que réside la caractéristique de la phase plastique, mais dans le changement de mobilité des molécules. Dans la phase plastique comme dans la phase cristalline, elles restent bien en place aux n?uds du réseau. Mais les molécules prennent la liberté de tourner sur elles-mêmes. Leur forme globulaire leur facilite cette rotation. C'est cet élément de liberté qui en fait une phase mésomorphe.
Voici quelques substances qui donnent des phases de cristaux plastiques: adamantanone, pentachloronitrobenzene, éthanol, carborane, camphre ou bornéol, dichlorobenzène, cyclohexane, cyclohexanol, fullerène.
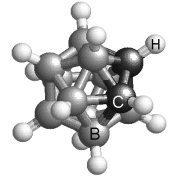 |  | 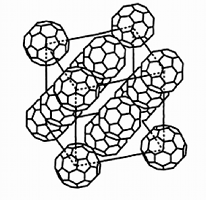 |
| Carborane: La molécule B10C2H12 est un icosaèdre (20 triangles et 12 sommets - voir Géométrie cristalline). C'est presque une sphère. | Molécule de fullerène ou C60 | Empilement cristallin du C60 |
Le fullerène est fait de molécules d'au moins 60 atomes de carbone (d'où son nom de C60). Ils sont répartis en hexagones et en pentagones dessinant un polyèdre semi-régulier, une forme proche d'une sphère. Son diamètre est de 0,7 nm, vraiment très petit. Il existe toute une famille de ces molécules. Le C60 a la capacité de s'empiler en une structure cubique à faces centrées.
Le C60 a été synthétisé et étudié en 1985 par Harry Kroto de l'Université de Sussex (Angleterre) en collaboration avec l'équipe du professeur Smalley et Bob Curl à Houston (U.S.A.). On l'a baptisé plus tard du nom de fullerène en hommage à l'architecte Buckminster Fuller surtout réputé pour la conception des dômes géodésiques (voir Réseaux planétaires et polyèdres).
Si vous êtes familier avec les documentations techniques des écrans de télévision, d'ordinateurs ou de téléphones, vous savez que beaucoup d'entre eux sont construits selon la technologie des cristaux liquides ou LCD (Liquid Crystal Display). L'article présent, pas plus que les autres articles de ce site, n'a la vocation d'exposer des informations technologiques. Je rappelle que le but de mes articles est de décrire les forces de la matière et les forces de la vie et de mieux faire comprendre comment elles interagissent avec nous. Toutefois, après ces explications sur les molécules des cristaux liquides et les changements de symétrie de leurs structures, une question peut venir naturellement à l'esprit, à laquelle je vais donner des éléments de réponse: Quel rapport ces structures ont-elles avec l'affichage? Qu'est-ce qui les rend appropriées à un tel usage?
Réponse: Les cristaux liquides ont des caractéristiques optiques singulières. Les propriétés de diffusion, de transparence ou de réflexion de la lumière à travers une couche de cristal liquide peuvent être modifiées et contrôlées lorsque la couche est soumise à un champ électrique.
Prenons le cas d'un nématique. Il est caractérisé par l'orientation des molécules. Prenons un film qui couvre une très petite surface, une cellule qui est soit un petit segment, soit un petit point à l'échelle de notre vision. Ce sera un point d'une image (pixel) ou le segment d'un chiffre. Toutefois, la surface de ce film à l'échelle microscopique est suffisamment importante pour contenir de nombreux domaines avec des orientations moléculaires différentes. S'il est éclairé par devant ou par transparence, la lumière est diffuse, le film est laiteux, non transparent. Or sous l'effet du champ électrique, ces molécules s'orientent plus ou moins fortement dans le sens du champ, en fonction de la force de celui-ci et toutes deviennent alignées. Le film devient transparent.
Le fonctionnement des écrans à cristaux liquides repose sur ces changements d'orientation en présence d'un champ électrique. Quand le champ électrique est activé, la structure est par exemple transparente et on ne voit pas le pixel. Quand le champ est coupé, la structure revient dans son état désordonné d'origine, diffuse la lumière et devient visible. On peut ainsi allumer et éteindre le pixel.
La technologie réelle est plus sophistiquée pour gagner en contraste et faire en sorte que la vision ne soit pas trop affectée par l'angle de vue. Il existe plusieurs procédés. L'un d'eux est l'effet de nématique torsadé (TN). Voici son principe:
Le nématique est déposé entre les deux surfaces de verre d'une cellule. Or il est possible de préparer la surface de verre de telle sorte que les bâtonnets soient posés à plat et forcés d'adopter une orientation. Tous les bâtonnets sont orientés de la même façon à la surface de la plaque inférieure et de la même façon à la surface de la plaque supérieure. Mais on s'arrange pour que ces deux orientations soient décalées de 90°. Le nématique est donc torsadé de l'une à l'autre.
On accole un polariseur à l'extérieur de chaque surface de verre, eux-mêmes tournés à 90°. On éclaire la surface. Le rôle d'un polariseur est de filtrer la lumière afin de ne conserver que celle qui vibre dans une direction précise. En l'absence de nématique, la direction imposée par le premier polariseur est arrêtée par le deuxième, aucune lumière ne passe. Mais lorsque le nématique torsadé est présent, il fait lui-même tourner la lumière de 90° qui n'est plus arrêtée. La cellule est allumée.
Chacune des deux surfaces de verre est recouverte d'un film conducteur pour appliquer un champ électrique. Lorsque l'on applique le champ, les molécules s'alignent progressivement suivant la direction du champ. La lumière n'est plus déviée par les molécules, elle est donc arrêtée par le deuxième polariseur. La cellule est éteinte.
Si on coupe le champ électrique, la structure torsadée se reforme, et la cellule se rallume.
Des articles de A. Boudet
Un livre de A. Boudet
Articles sur des sites web
en anglais
Texte conforme à la nouvelle orthographe française (1990)
01 octobre 2011